研究実施中~終了までの手続き
臨床研究申請(必須)様式等一覧表
変更申請
研究分担者及び協力者、研究実施計画書や同意説明文書等に変更のある場合は下記資料をご提出ください。
・臨床7 研究の変更に関する報告書 ≪必須≫
・臨床2 研究分担者・研究協力者リスト
・変更対比表(もしくは変更箇所がわかる文書)
・変更後の文書
・多施設共同研究の場合は主たる研究機関でのIRB承認書(変更の可否を示した承認書)の写し
|
様式 阪院–臨床7 |
研究の変更に関する報告書(生命・医学系指針用) | |||||||
|
様式 阪院–臨床7 |
研究の変更に関する報告書(医学系指針用) | |||||||
| 様式 阪院–臨2 | 研究分担者・研究協力者リスト(生命・医学系指針用) | 〇 | ||||||
| 様式 阪院–臨2 | 研究分担者・研究協力者リスト(医学系指針用) | 〇 | ||||||
| 単施設用情報公開文書(オプトアウトによる場合) | ||||||||
| 多施設用情報公開文書(オプトアウトによる場合) | ||||||||
|
書式19-5 |
受託研究(治験以外)契約書 | |||||||
|
書式19-3 |
契約内容変更に関する覚書 | |||||||
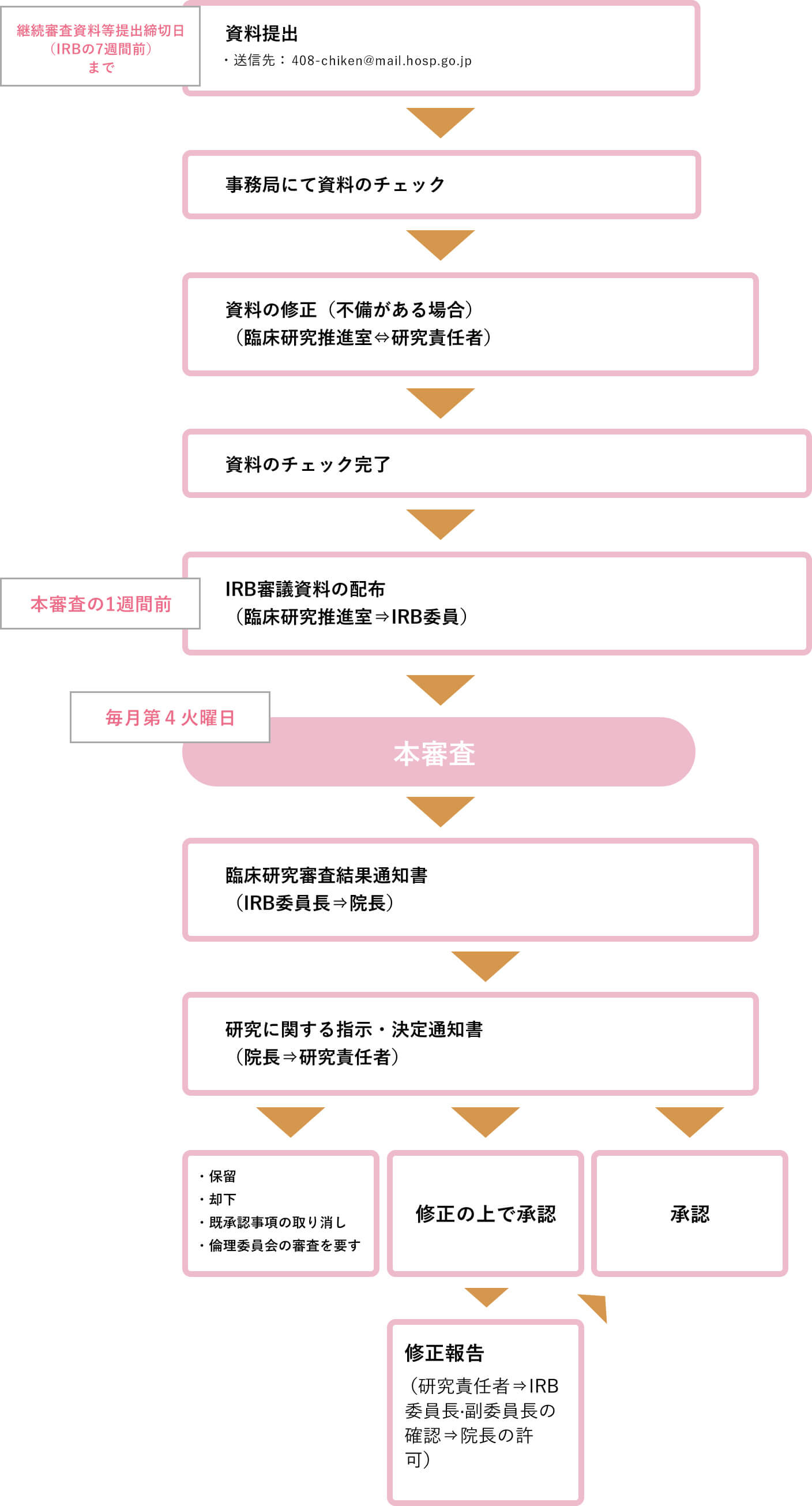
継続申請
RB承認済臨床研究は、研究許可後1年毎に継続審査を受ける必要があり、継続審査で承認されない場合当該研究は中止となります。
事務局より本書式の提出期限を連絡しますので、必ず提出期限を厳守して下さるようお願い致します。
重篤な有害事象報告
重篤な有害事象が発生した場合、速やかにご提出下さい。
|
様式 阪院–臨床8 |
重篤な有害事象に関する報告書 | |||||||
終了報告
研究終了後にご提出下さい。
| 様式 阪院-臨床12 | 臨床研究終了報告書 | 〇 |
最終公表の報告
終了報告書提出後、研究結果が公表された場合、ご提出下さい。
|
様式 阪院–臨床13 |
結果の公表に関する報告書 | |||||||
臨床研究 研究実施~終了まで