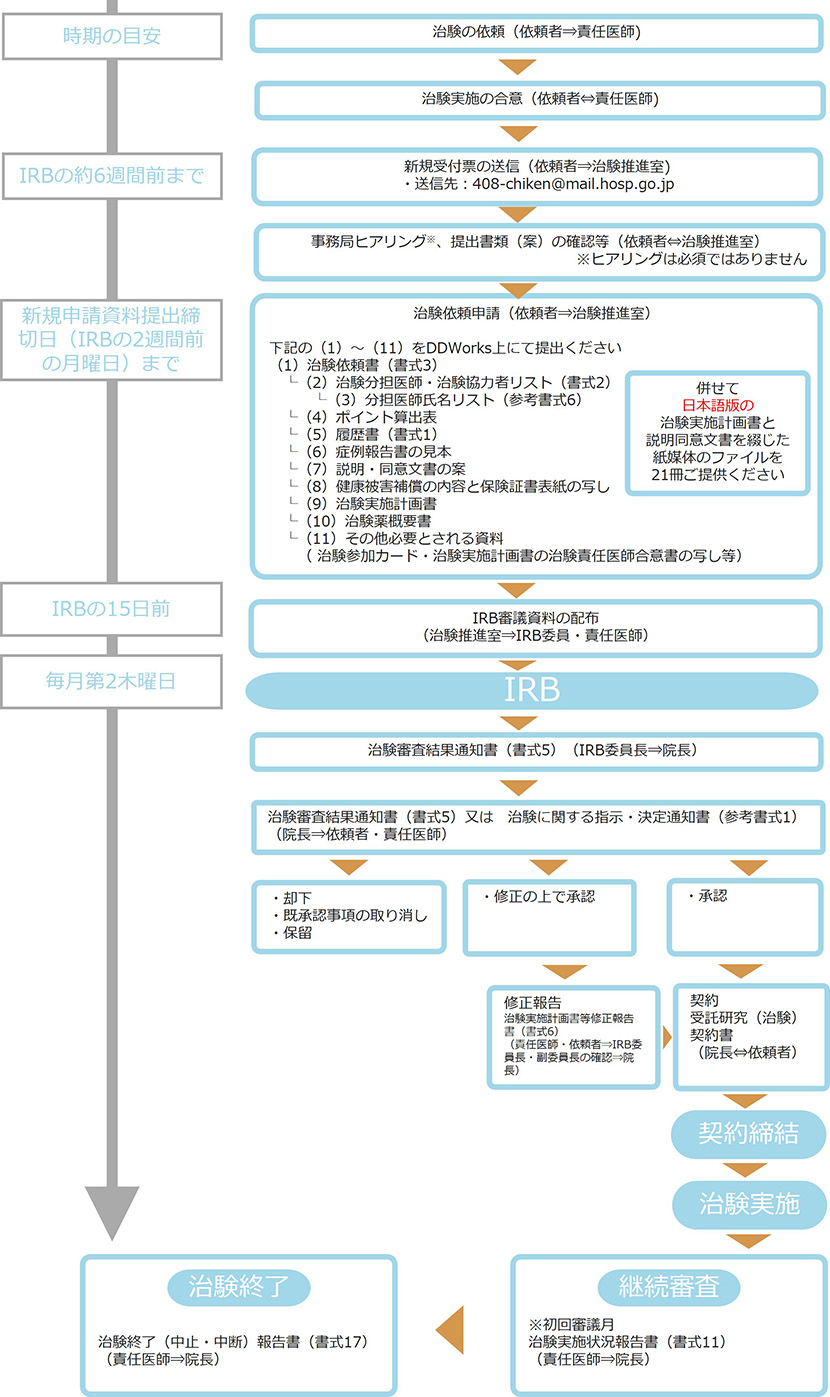
治験・製造販売後臨床試験 新規申請手続きの流れ
■新規申請をご希望の場合は、ダウンロードした新規受付票に必要事項をご記入の上、下記アドレスまでお送り下さい。
※ご注意※
GCP規定の治験実施計画書の合意後、希望するIRBの6週間前までにお送りください。
当院は統一書式の作成、授受、保管に「DDworks Trial Site(DDTS)」を使用しています。
DDworks Trial Siteによる電磁的保存
- 国立病院機構大阪医療センター受託研究取扱細則補遺
(DDworks Trial Siteを利用した治験関連文書の電磁化に関する細則) - 治験関連文書を電磁的記録として扱う際に確認すべきチェックリストDDTS
治験・製造販売後臨床試験 新規申請時提出書式一覧
新規申請時
|
書式No |
様式名 |
治験(医薬品) |
製造販売後臨床試験(医薬品) |
治験・製造販売後臨床試験(医療機器) |
|---|---|---|---|---|
| 書式1 | 履歴書 | |||
| 書式2 | 治験分担医師・治験協力者 リスト | |||
| 書式3 | 治験依頼書 | |||
| 参考書式6 | 分担医師氏名リスト | |||
| 様式1-1 | 受託研究(治験)契約書(二者契約用) | |||
| 別表1 | 臨床研究経費ポイント算出表 | |||
| 別表5 | 製造販売後臨床試験研究経費研究経費ポイント算出表 | |||
| 別表6 | 調査医薬品管理経費研究経費ポイント算出表 | |||
| 別表7 | 拡大治験研究経費ポイント算出表 | |||
| 研究実施計画書(合意が確認できるもの又は責任医師用の合意書 |
○ |
○ |
○ |
|
| 治験薬等概要書 |
○ |
◎ |
||
| 症例報告書の見本 |
○ |
○ |
○ |
|
| 説明・同意文書の案 |
○ |
○ |
○ |
|
| 健康被害補償の内容と保険証書表紙の写し |
○ |
○ |
○ |
|
| 添付文書・パンフレット等 |
○ |
◎ |
◎はどちらか該当するもの
説明文書・同意書治験参加カードの定型文について
治験・製造販売後臨床試験 実施中の手続き
同意説明文書改訂
治験実施計画書等の改訂
分担医師の追加
|
書式No. |
書式名 |
治験(医薬品) |
製造販売後臨床試験(医薬品) |
治験・製造販売後臨床試験(医療機器) |
|---|---|---|---|---|
| 書式10 | 治験に関する変更申請書 | |||
| 参考書式6 | 分担医師氏名リスト | |||
| 書式2 | 治験分担医師・治験協力者 リスト |
重篤な有害事象に関する報告
|
書式No. |
書式名 |
治験(医薬品) |
製造販売後臨床試験(医薬品) |
治験・製造販売後臨床試験(医療機器) |
治験・製造販売後臨床試験(再生医療等製品) |
|---|---|---|---|---|---|
| 書式12 | 重篤な有害事象に関する報告書(医薬品治験) | ||||
| 重篤な有害事象に関する報告書(医薬品治験:詳細記載用) | |||||
| 書式13 | 有害事象に関する報告書(医薬品製造販売後臨床試験) | ||||
| 有害事象に関する報告書(医薬品製造販売後臨床試験:詳細記載用) | |||||
| 書式14 | 重篤な有害事象及び不具合に関する報告書(医療機器治験) | ||||
| 重篤な有害事象及び不具合に関する報告書(医療機器治験:詳細記載用) | |||||
| 書式15 | 有害事象及び不具合に関する報告書(医療機器製造販売後臨床試験) | ||||
| 有害事象及び不具合に関する報告書(医療機器製造販売後臨床試験:詳細記載用) | |||||
| 書式19 | 重篤な有害事象及び不具合に関する報告書(再生医療等製品治験) | ||||
| 重篤な有害事象及び不具合に関する報告書(再生医療等治験:詳細記載用) | |||||
| 書式20 | 重篤な有害事象及び不具合に関する報告書(再生医療等製品製造販売後臨床試験) | ||||
| 重篤な有害事象及び不具合に関する報告書(再生医療等製品製造販売後臨床試験:詳細記載用) |
安全性情報等に関する報告
治験実施計画書からの逸脱に関する報告
|
書式No. |
書式名 |
治験(医薬品) |
製造販売後臨床試験(医薬品) |
治験・製造販売後臨床試験(医療機器) |
|---|---|---|---|---|
| 書式8 | 緊急の危険を回避するための治験実施計画書からの逸脱に関する報告書 | |||
| 書式9 | 緊急回避逸脱通知書 |
▲緊急の危険回避のための逸脱










