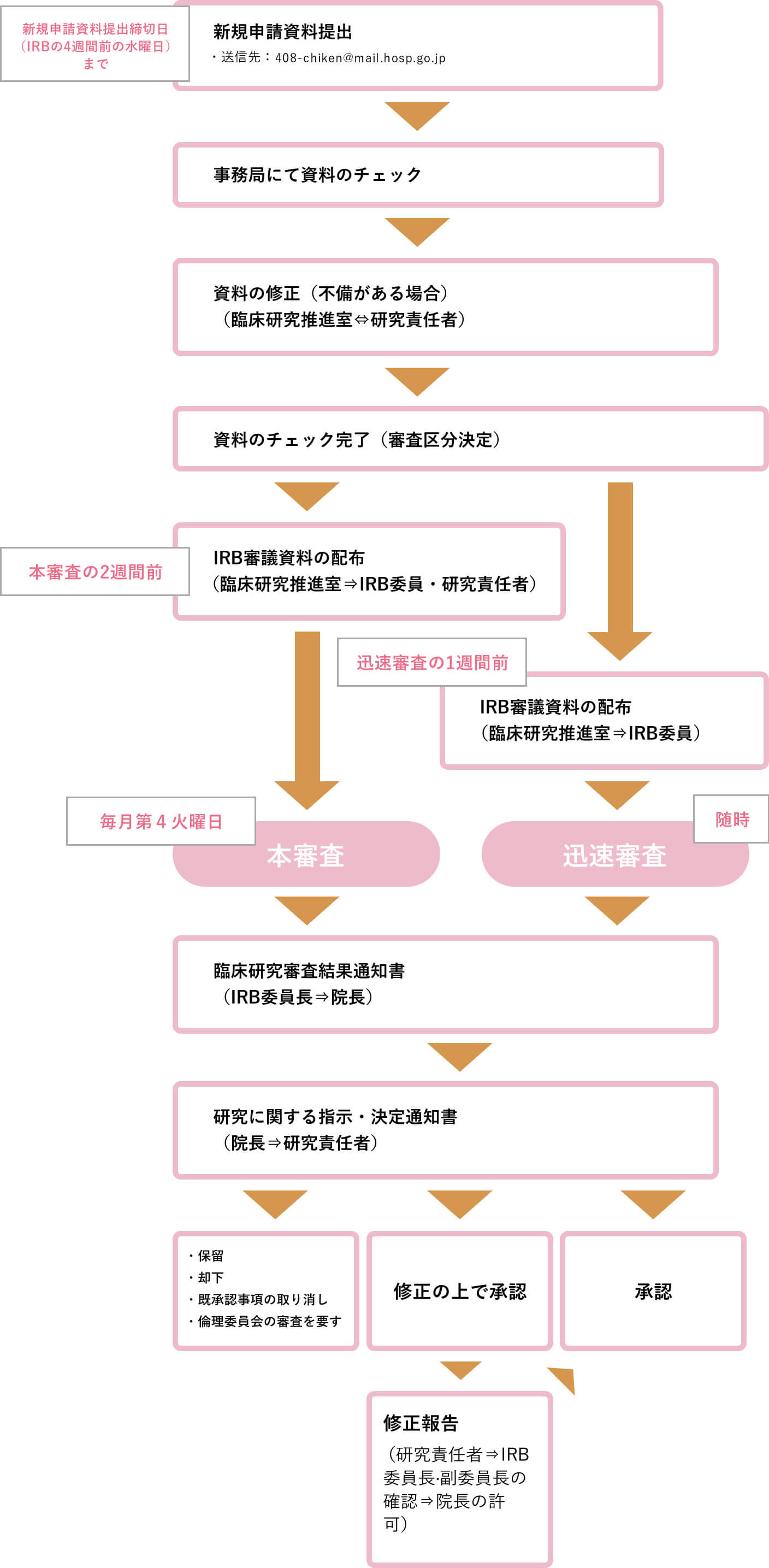
新規の手続き(通常書式)
臨床研究申請(必須)様式等一覧表
※一括審査用の様式が必要な方は408-chiken@mail.hosp.go.jpにメールください
〇必須 △ある場合は必須
| 書式No. | 書式名 | 通常書式 | ||||||
|---|---|---|---|---|---|---|---|---|
| 様式 阪院–臨1 | 臨床研究審査依頼・許可申請書(生命・医学系指針用) | 〇 | ||||||
| 様式 阪院–臨1 | 臨床研究承認申請書(医学系指針用) | 〇 | ||||||
| 様式 阪院–臨2 | 研究分担者・研究協力者リスト(生命・医学系指針用) | 〇 | ||||||
| 様式 阪院–臨2 | 研究分担者・研究協力者リスト(医学系指針用) | 〇 | ||||||
| 研究実施計画書 | 〇 | |||||||
| 研究計画書チェックリスト(生命・医学系指針用) | 〇 | |||||||
| 研究計画書チェックリスト(医学系指針用) | 〇 | |||||||
| 説明文書および同意文書 | △ | |||||||
| 説明文書チェックリスト(生命・医学系指針用) | △ | |||||||
| 説明文書チェックリスト(医学系指針用) | △ | |||||||
| 単施設用情報公開文書(オプトアウトによる場合) | △ | |||||||
| 多機関用情報公開文書(オプトアウトによる場合) | △ | |||||||
| 主たる研究機関でのIRB承認書(多機関共同研究の場合) | △ | |||||||
| 症例登録票の見本(EDCの場合は登録画面の見本等) | △ | |||||||
| 症例報告書の見本(EDCの場合は入力画面の見本等) | △ | |||||||
| モニタリングに関する手順書 | △ | |||||||
| 監査に関する手順書 | △ | |||||||
| 製品に関する添付文書(医薬品、医療機器等を使用する場合) | △ | |||||||
| 公開データベース登録文書(介入研究の場合のみ) | △ | |||||||
臨床研究 新規の手続き