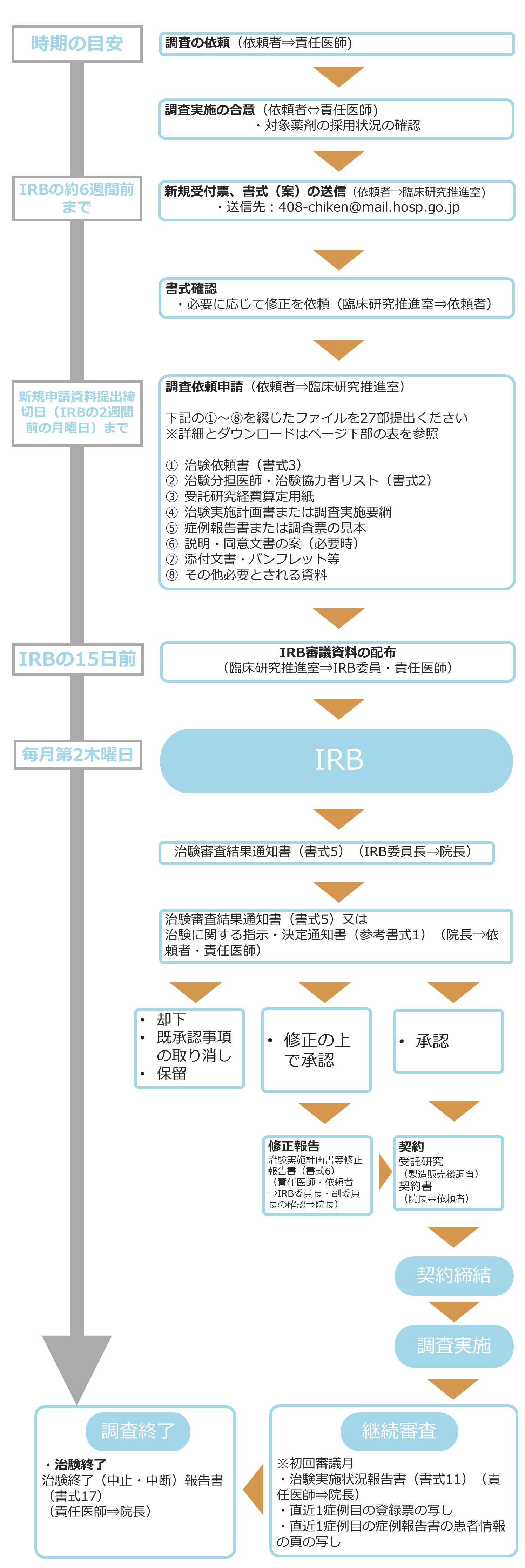
製造販売後調査 新規申請手続きの流れ
製造販売後調査 新規申請時提出書式一覧
新規申請時
|
書式No |
様式名 |
製造販売後調査 |
|---|---|---|
| 書式2 | 治験分担医師・治験協力者 リスト | |
| 書式3 | 治験依頼書 | |
| 様式1-2 | 受託研究(製造販売後調査)契約書 | |
| 別紙基準4 | 受託研究経費算定用紙 4.市販後調査に係る経費算出基準 (1)使用成績調査・特定使用成績調査 |
|
| 製造販売後調査実施計画書(実施要綱) |
○ |
|
| 症例報告書の見本 |
○ |
|
| 添付文書・パンフレット等 |
○ |
◎はどちらか該当するもの
製造販売後調査 実施中の手続き
実施要綱等の改訂、契約期間・症例数等の変更
|
書式No. |
書式名 |
製造販売後調査 |
|---|---|---|
| 書式10 | 治験に関する変更申請書 | |
| 様式1-4 | 契約内容変更に関する覚書(二者契約用) ※2017年4月以降 |
|
| 様式1-5 | 契約内容変更に関する覚書(三者契約用) ※2017年3月まで |
|
| 別紙基準4 | 受託研究経費算定用紙 4.製造販売後調査に係る経費算出基準 (2)製造販売後臨床試験経費 |
|
| 変更・改訂後の資料等 |
○ |
注1:●は研究経費の変更が伴う場合必要
注2:◎、( )はどちらか該当するもの
注3:別表及び別紙基準は変更前後を提出
分担医師の追加
安全性情報等に関する報告
|
書式No. |
書式名 |
製造販売後調査 |
|---|---|---|
| 書式16 | 安全性情報等に関する報告書 | |
| 報告内容の詳細がわかる資料等 |
○ |
治験実施計画書からの逸脱に関する報告
▲緊急の危険回避のための逸脱
治験実施状況報告
|
書式No. |
書式名 |
製造販売後調査 |
|---|---|---|
| 書式11 | 治験実施状況報告書 | |
| 1症例目の登録票の写し |
○ |
|
| 1症例目の症例報告書の患者情報の頁の写し |
○ |
治験終了(中止・中断)報告
|
書式No. |
書式名 |
製造販売後調査 |
|---|---|---|
| 書式17 | 治験終了(中止・中断)報告書 |










